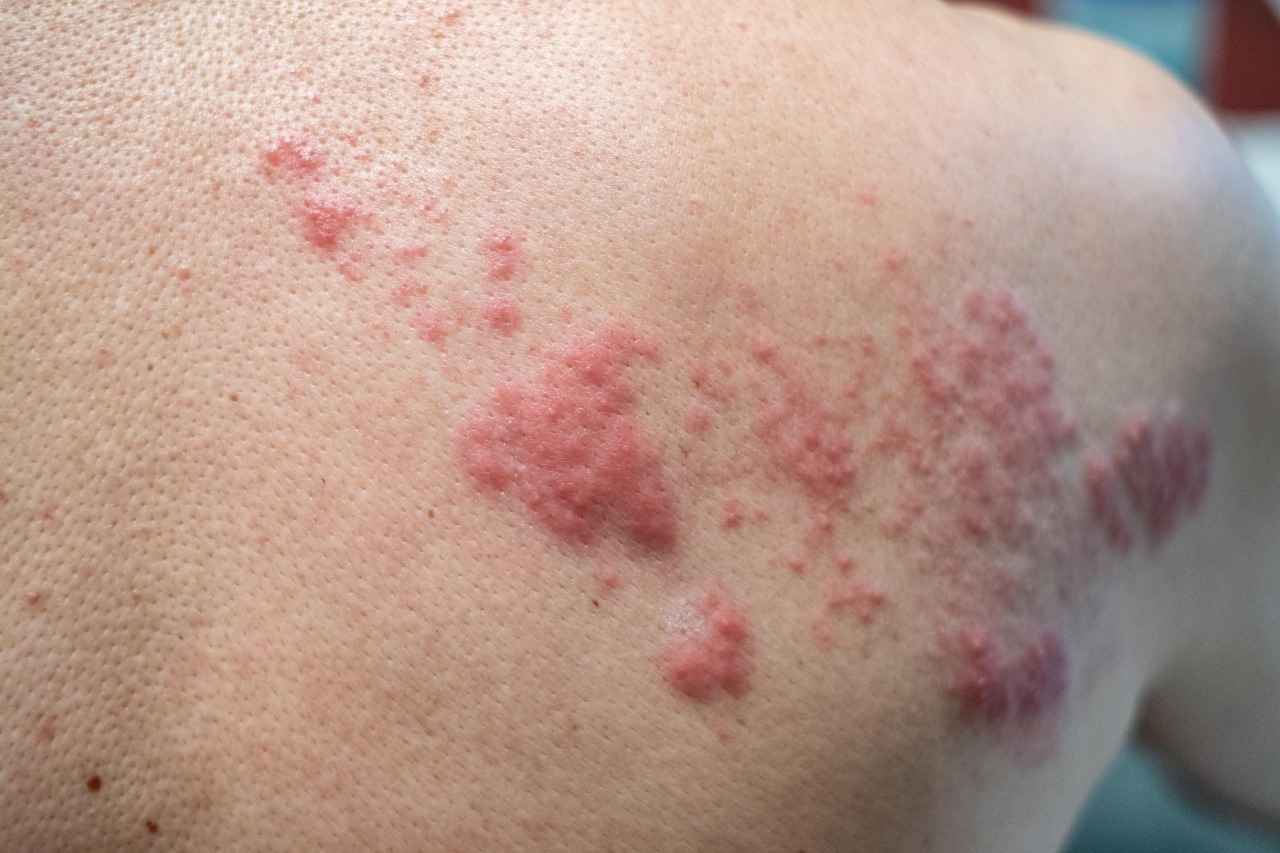
أعلنت اليوم شركة “تاكيدا” للصناعات الدوائية المحدودة (المدرجة في بورصة طوكيو تحت الرمز: TSE:4502)، أن المفوضية الأوروبية وافقت على تغيير من النوع الثاني لــ”أدسيتريس” (برينتوكسيماب فيدوتين) بحيث يتضمن بيانات عن إعادة علاج المرضى البالغين الذين يعانون من لمفومة هودجكين الانتكاسية أو المقاومة للعلاج أو لمفومة الخلايا الكبيرة الكشمية المجموعية الانتكاسية أو المقاومة للعلاج الذين استجابوا سابقاً للعلاج بـ”أدسيتريس” وانتكسوا لاحقاً. ويأتي قرار المفوضية الأوروبية على إثر الرأي الإيجابي الصادر عن لجنة المنتجات الطبية للاستخدام البشري في أكتوبر 2015.
وقد حصل “أدسيتريس” على ترخيص مشروط بالتسويق من قبل المفوضية الأوروبية في عام 2012 لعلاج لمفومة هودجكين الانتكاسية أو المقاومة للعلاج والذي يعطي نتائج إيجابية لفحص “سي دي 30” بعد الخضوع لزرع الخلايا الجذعية ذاتية المنشأ، أو بعد اثنين من العلاجات السابقة على الأقل عندما لا يكون زرع الخلايا الجذعية ذاتية المنشأ أو العلاج الكيميائي متعدد العوامل خياراً علاجياً، ولعلاج لمفومة الخلايا الكبيرة الكشمية المجموعية الانتكاسية أو المقاومة للعلاج.
ويتضمن “ملخص مواصفات المنتج” تحديثاً للأقسام السريرية ومن ضمنها السلامة بحيث تتضمن بيانات عن إعادة معالجة المرضى البالغين الذين استجابوا لعلاج سابق بـ”أدسيتريس” (استجابة كاملة أو استجابة جزئية) في دواعي الاستخدام الحالية ولكن حالتهم انتكست لاحقاً.
وارتكزت التغييرات من النوع الثاني على بيانات من المرحلة الثانية من دراسة “إس جي إن 006-35- الجزء ’أ‘” التي أظهرت إمكانية التوصل إلى استجابات فعالة مضادة للأورام لدى غالبية المرضى المصابين بلمفومة هودجكين الانتكاسية أو المقاومة للعلاج والمرضى المصابين بلمفومة الخلايا الكبيرة الكشمية المجموعية الانتكاسية أو المقاومة للعلاج من خلال إعادة العلاج بـ”أدسيتريس”. وكانت نتائج السلامة والفعالية من هذه التجربة تتماشى مع النمط الإيجابي الذي بيّنته دراستين محوريتين من المرحلة الثانية (’إس جي إن 003-35 وإس جي إن 004-35‘).
وفي هذا السياق، قال البروفسور الطبيب أنطون هاجنبيك الحائز على درجة الدكتوراه وأستاذ أمراض الدم ، قسم أمراض الدم، في المركز الطبي الأكاديمي التابع لجامعة أمستردام: “قام ’أدسيرتيس‘ بتغيير عالم العلاج للمرضى المصابين بلمفومة هودجكين الانتكاسية أو المقاومة للعلاج والمرضى المصابين بلمفومة الخلايا الكبيرة الكشمية المجموعية الانتكاسية أو المقاومة للعلاج في أوروبا وبرز كأداة قيّمة لتحفيز الشفاء. إلا أن اللمفومة مرض شديد ويحدث الانتكاس في بعض الحالات التي يصعب معالجتها. يمكننا الآن مع فرصة إعادة العلاج، تزويد المرضى الذي ليس لديهم سوى خيارات محدودة للغاية، بفرصة أخرى للاستفادة المحتملة من ’أدسيتريس‘”.
وفي السياق نفسه، قال الطبيب ديرك هوبنر، المدير التنفيذي الطبي لوحدة المجال العلاجي لعلم الأورام لدى “تاكيدا”: “يعتبر قرار المفوضية الأوروبية الذي يقضي بإدراج بيانات عن إعادة العلاج في ملصق ’أدسيرتيس‘ مهماً في تطوير رعاية المرضى الذي يحاربون هذه الأمراض. نتطلع إلى مواصلة برنامجنا السريري المستمر لـ’أدسيتريس‘ في لمفومة هودجكين ولمفومة الخلايا الكبيرة الكشمية المجموعية إضافة إلى مجموعة متنوعة من أشكال أخرى من اللمفومة بهدف توفير هذا العلاج المهم للمرضى الذين قد يستفيدون منه”.
للمزيد من التفاصيل حول قرار المفوضية الأوروبية، الرجاء زيارة الموقع الإلكتروني لوكالة الأدوية الأوروبية: www.ema.europa.eu/ema.
دراسة “إس جي إن 006-35”-الجزء “أ”
تعتبر دراسة (إس جي إن 006-35 الجزء “أ”) التي تحمل عنوان: “العلاج بـ’إس جي إن-35‘ لدى المرضى المصابين بأورام خبيثة في الدم تعطي نتيجة إيجابية لفحص مؤشر “سي دي 30” شاركوا في السابق في دراسة ’إس جي إن-35‘”، دراسة مفتوحة التسمية متعددة المراكز من المرحلة الثانية.
وقد تم تصميم الدراسة لتقييم إعادة العلاج بـ”أدسيتريس” لدى المرضى المصابين بلمفومة هودجكين (20 مريضاً) أو لمفومة الخلايا الكبيرة الكشمية المجموعية (8 مرضى) الذين انتكست حالتهم بعد استجابة سابقة لـ”أدسيتريس” (الجزء ’أ‘). وكانت الأهداف الأولية للدراسة السلامة والاستجابة المضادة للورم, أما الأهداف الثانوية فكانت مدة التحكّم بالورم بما في ذلك مدة الاستجابة والبقاء على قيد الحياة من دون تقدم للمرض والبقاء الإجمالي على قيد الحياة وظهور أجسام مضادة تتنافى مع العلاج.
للمزيد من المعلومات حول التجربة، الرجاء زيارة الموقع الإلكتروني التالي: www.clinicaltrialsregister.eu.

European Commission Approves Label Variation for ADCETRIS® (Brentuximab Vedotin) to Include Data on Retreatment of Adult Patients with Relapsed or Refractory Hodgkin Lymphoma and Systemic Anaplastic Large Cell Lymphoma (sALCL)
Today announced that the European Commission (EC) has approved a Type II variation for ADCETRIS® (brentuximab vedotin) to include data on the retreatment of adult patients with relapsed or refractory (R/R) Hodgkin lymphoma or R/R systemic anaplastic large cell lymphoma (sALCL) who previously responded to ADCETRIS and who later relapse. The decision from the EC follows a positive opinion from the Committee for Medicinal Products for Human Use (CHMP) in October 2015
ADCETRIS was granted conditional marketing authorization by the EC in 2012 for the treatment of R/R CD30+ Hodgkin lymphoma following autologous stem cell transplant (ASCT), or at least two prior therapies when ASCT or multi-agent chemotherapy is not a treatment option, and for R/R sALCL
The SmPC variation includes an update to the clinical sections, including safety, to include data on retreatment of adult patients who have responded to previous treatment with ADCETRIS (CR or PR) under the existing indications, but later relapsed
The Type II variation is based on data from the Phase 2 SGN35-006 Part A study that demonstrated effective anti-tumor responses can be achieved in the majority of R/R Hodgkin lymphoma and sALCL patients with ADCETRIS retreatment. The safety and efficacy results from this trial were consistent with the positive profile demonstrated in the pivotal Phase 2 studies SGN35-003 and SGN35-004
“ADCETRIS has transformed the treatment landscape for relapsed/refractory Hodgkin lymphoma and sALCL patients in Europe, and has emerged as a most valuable tool to induce a remission. However, lymphoma is a relentless disease, and relapse occurs in some of these very difficult to treat patients. Now, with the opportunity for retreatment, we can offer patients with very limited options another chance to potentially benefit from ADCETRIS,” said Professor Anton Hagenbeek, M.D., Ph.D., Professor of Hematology, Department of Hematology, Academic Medical Center in the University of Amsterdam
“The EC decision to include data on retreatment in the ADCETRIS label is important in advancing care for patients battling these diseases,” said Dirk Huebner, M.D., Executive Medical Director, Oncology Therapeutic Area Unit, Takeda. “We look forward to continuing our ongoing clinical program of ADCETRIS in Hodgkin lymphoma and sALCL, as well as in a variety of other forms of lymphoma, with the goal of bringing this important therapy to patients who might benefit from it
For further details about the EC decision, please visit the EMA website: www.ema.europa.eu/ema


 أسواق4 سنوات ago
أسواق4 سنوات ago
 عقارات4 سنوات ago
عقارات4 سنوات ago
 سيارات5 سنوات ago
سيارات5 سنوات ago
 فن4 سنوات ago
فن4 سنوات ago
 منوعاتسنتين ago
منوعاتسنتين ago
 مطاعم4 سنوات ago
مطاعم4 سنوات ago
 عطورات3 سنوات ago
عطورات3 سنوات ago
 عطورات4 سنوات ago
عطورات4 سنوات ago